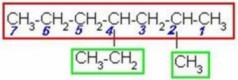
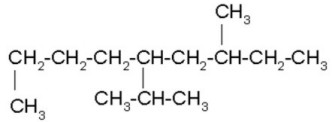
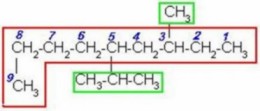
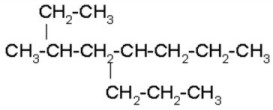
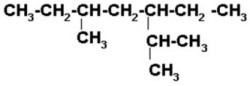
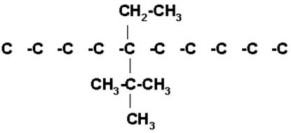
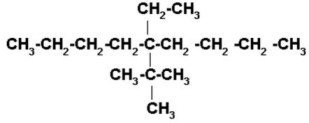
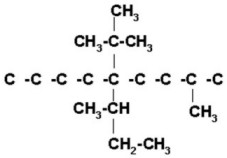
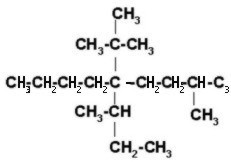
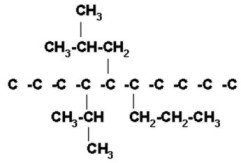
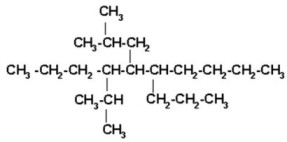
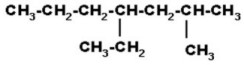FUNCIÓN QUÍMICA:
Se llama función Química al
conjunto de propiedades comunes a una serie de compuestos análogos. Se conocen
funciones en las dos químicas, mineral y orgánica; así son funciones de la
química mineral la función anhídrido, función óxido, función ácido, función
base y función sal.
Las funciones de la química
orgánica son muchas más, destacándose entre todas la función hidrocarburo,
porque de ella se desprenden todas las demás. Para mayor claridad dividimos las
funciones orgánicas en dos grupos, que designamos con los nombres de
fundamentales y especiales. Las funciones fundamentales son: la función
alcohol, función aldehído, función cetona y función ácido. Las funciones
especiales son: la función éter, la función éster, función sal orgánica,
función amina y amida y funciones nitrilo y cianuro.
GRUPO FUNCIONAL
Son ciertos grupos de átomos
comunes a todos los cuerpos de una misma función y cuya presencia nos revela
determinadas y parecidas propiedades en los cuerpos que los poseen.
En química orgánica, átomo o
grupo de átomos unidos de manera característica y que determinan,
preferentemente, las propiedades del compuesto en el que están presentes.
Los grupos funcionales reciben
nombres especiales, por ejemplo, -NH2 es el grupo amino y -CONH2 es el grupo
amido. Es posible estudiar a grandes rasgos las propiedades de los compuestos
orgánicos refiriéndose a las características de cada grupo funcional.
Los compuestos orgánicos que
poseen un mismo grupo funcional y que difieren sólo en un número entero de
grupos metileno, -CH2-, se clasifican como miembros de una misma serie homóloga
y se pueden representar por una fórmula molecular general. La progresiva
introducción de grupos metileno en los miembros de una serie homóloga produce
una suave variación de las propiedades determinadas por el grupo funcional.
El conjunto del grupo funcional
con el carbono que lo contiene recibe el nombre de función carbonada. Muchos
son los grupos funcionales, varios de los cuales pueden coexistir dentro de una
misma molécula. Con todo, la multiplicidad de grupos funcionales en una misma
molécula es más peculiar de las sustancias organizadas que integran los
organismos vivos animales y vegetales, que de las obtenidas en el laboratorio y
en la industria.
Los grupos funcionales ayudan a
determinar los tipos de reacciones químicas en que participan los compuestos.
La mayoría de estos grupos forman asociaciones con facilidad (ej: enlaces
iónicos y de hidrógenos) con otras moléculas. Se usa el símbolo R para
determinar el resto de la molécula de que es parte el grupo funcional.
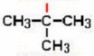
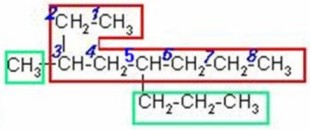
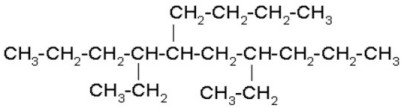
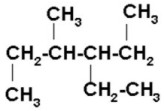
CICLO ALCANO
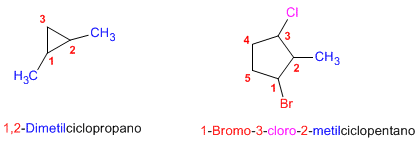
Nomenclatura de cicloalcanos
Los cicloalcanos se nombran con
el prefijo ciclo- seguido del nombre del alcano con igual número de carbonos.
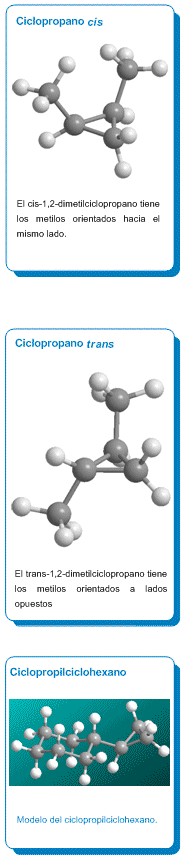
Los cicloalcanos presentan isomería cis/trans. Cuando los sustituyentes se
encuentran por la misma cara de la molécula, se dice que están cis; cuando se
encuentran por caras opuestas, se dice que están trans.
Propiedades físicas
Presentan mayores puntos de
fusión y ebullición que los correspondientes alcanos de igual número de
carbonos. La rigidez del anillo permite un mayor número de interacciones
intermoleculares, que es necesario romper mediante la aportación de energía,
para pasar las moléculas a fase gas.
Tensión anular
Los cicloalcanos de pequeño
tamaño (ciclopropano, ciclobutano) presentan una tensión importante debida a
los ángulos de enlace y a los eclipsamientos. Los cicloalcanos de mayor tamaño
como ciclopentano y ciclohexano están casi libres de tensión.
Isómeros conformacionales en el
ciclohexano
El ciclohexano se dispone en
forma de silla para evitar los eclipsamientos entre hidrógenos. La forma de
silla del ciclohexano contiene dos tipos de hidrógenos; los axiales que se
sitúan perpendiculares al plano de la molécula y los ecuatoriales colocados en
el mimo plano.
Equilibrio ecuatorial-axial en ciclohexano
sustituidos
El ciclohexano presenta un
equilibrio conformacional que interconvierte los hidrógenos ecuatoriales en
axiales y viceversa. Cuando un ciclohexano está sustituido la conformación que
más grupos sitúa en posición ecuatorial es la más estable, encontrándose el
equilibrio conformacional desplazado hacia dicha conformación.
Construcción del nombre
Se nombran precediendo el nombre
del alcano del prefijo ciclo- (ciclopropano, ciclobutano,ciclopentano,
etc.). También se pueden nombrar como radicales cicloalquilo (ciclopropilo,
ciclobutilo, etc.)
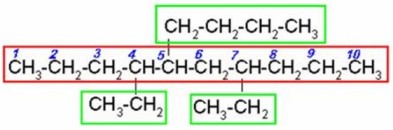
Numeración de la cadena
La numeración se realiza de modo
que se asignen los localizadores más bajos a los sustituyentes. En caso de no
decidir, se numera teniendo en cuenta el orden alfabético de los sustituyentes.
Cicloalcanos como
sustituyentes.
Hay casos en los que conviene
tomar el cicloalcano como sustituyente y la cadena carbonada como principal.
Isomería cis/trans
Los cicloalcanos presentan
estereoisomería y dependiendo de la posición de los grupos en el espacio
podemos tener isómeros cis o trans. Cuando los sustituyentes se encuentran del
mismo lado del anillo se denomina cis al estereoisómero, y si están a lados
opuestos trans.
QUERIDOS ESTUDIANTES MADRE DEL BUEN CONSEJO PARA EL DÍA MIÉRCOLES CADA GRUPO DEBE LLEVAR A CLASE 6 BOLAS DE ICOPOR No 4; 6 BOLAS DE ICOPOR No 3 Y 12 BOLAS DE ICOPOR No 2, DOCE PALILLOS PARA PINCHOS, VINILO NEGRO, ROJO Y AZUL, PINCELES Y COLBÓN . DE LA MISMA FORMA LOS ESTUDIANTES DEL SAN LUIS GANZAGA DEBEN LLEVAR ESTOS MATERIALES PARA EL DÍA MARTES. NO SE LES OLVIDE IMPRIMIR Y LLEVAR LA INFORMACIÓN DEL BLOG AL COLEGIO PARA EL TRABAJO DE LA SEMANA.
ANIMO CHICOS EL FUTURO LES PERTENECE.
PROFESOR MILTON
Agradezco la información a química orgánica,net y a wikipedia.
|